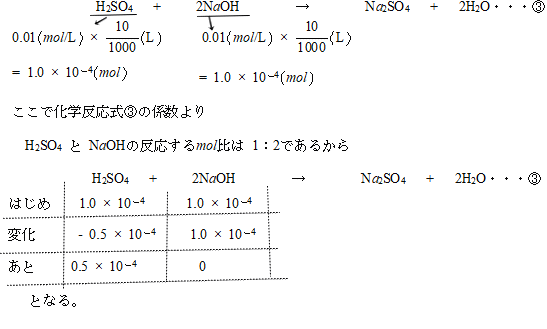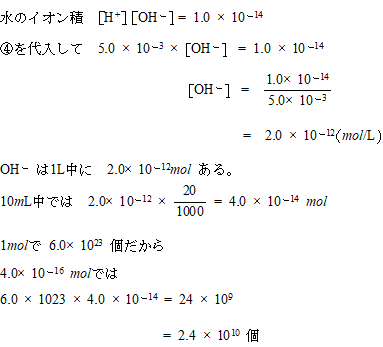金沢医科大学医学部2020年度化学入試問題
今回は 金沢医科大学医学部前期化学入試問題から[4]を解説します。
(ⅰ)は濃硫酸の希釈です。ポイントは希釈の前後で100%硫酸のモル数は変わらないというところです。
(ⅱ)は酸と塩基の中和反応です。このとき(ⅰ)で濃硫酸を希釈した硫酸ですから希硫酸です。
希硫酸は電離度1で扱ってよいとされるのが一般的です。
(希硫酸)→2(水素イオン)+(硫酸イオン)…①
また水酸化ナトリウムは電離度1と与えられているので
(水酸化ナトリウム)→(ナトリウムイオン)+(水酸化物イオン)…②
①と②は電離の式です。
①+②×2を計算して
(希硫酸)+2(水酸化ナトリウム)→(硫酸ナトリウム)+2(水)…③
答案には③の式から書いてあります。
熱濃硫酸は強い酸化力がありますが、熱濃硫酸も濃硫酸も水酸化ナトリウムと中和反応を起こすことはありません。中和反応を起こすのは希硫酸です。
(ⅲ)では(ⅱ)に引き続いているので
希硫酸についてということになります。③の反応の結果、液量20ml中に水素イオンが5×(10の-5乗)モル溶けていることから水素イオン濃度を計算してさらにpHを求めることになります。